病院業務・診療活動や学生教育を終えて研究室に戻るとほっと一息入れて、今度は血液細胞やがん細胞というミクロの世界に没頭します。研究室は手狭ですが、通常の細胞実験はもとより基本的な遺伝子実験や蛋白解析も、もちろん臨床に関する議論も大体この部屋でおこなっています。組み換えDNA実験や遺伝子導入、DNAシークエンシング、フローサイトメトリーやレーザー顕微鏡などは学内所轄のセンターでお世話になっています。教室員に加えて、川崎医療福祉大学の教員、中央検査部技師スタッフや学外からの客員研究員の出入りも活発で、さらに毎年秋になると医療福祉大の実習学生を迎え入れて、研究室はしばしば大賑わいになります。
(1) 骨髄異形成症候群の基礎生物学的研究
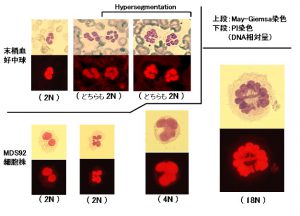
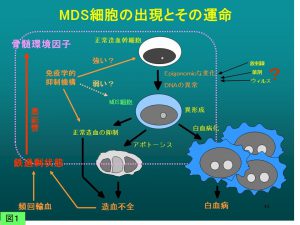
骨髄異形成症候群(myelodysplastic syndromes, MDS)は骨髄中に生じた異常クローンによる無効造血の結果としておこる後天性造血障害で、血球異形成像で特徴づけられます。骨髄細胞は一見保たれていますが、慢性・治療抵抗性の貧血・血球減少をきたしてしばしば骨髄不全に陥る一方、急性骨髄性白血病へ移行しやすい潜在的悪性性格を併せ持つ予後不良の骨髄疾患です(図1)。
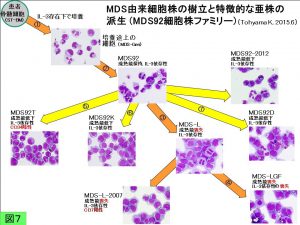
当研究室では種々の血液細胞株を駆使して、遺伝子導入やRNA干渉法等の手法を用いて、MDSの白血病化機構の解明と新規薬剤の作用機序の解析を主なテーマとして研究を進めています。とりわけ独自に樹立したMDS細胞株(MDS92およびMDS-L;図2,3)は世界的にも他に例を見ないユニークなMDS細胞株で、しかも5番染色体長腕異常やモノソミー7を有することから、国内外の多数の施設から分与のご希望があり、喜んでお分けしております(培養が少々難しいほうではありますが)。
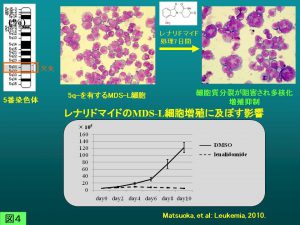
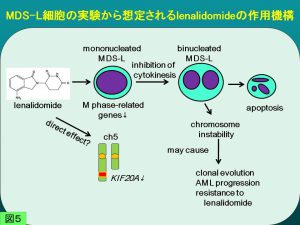
MDS92は分化した異形成細胞を生じつつ長期間培養可能で、異形成出現のメカニズムを探るうえで有用です。一方MDS-Lは増殖旺盛な芽球性亜株ですが、そのためかlenalidomideへの感受性が明瞭で、5q-MDSのモデル細胞として、病因遺伝子あるいはlenalidomide感受性関連分子の探索に用いています(図4,5)。 Dr.Ebertらは、lenalidomideがcereblonを介したE3-ubiquitin ligaseによるcasein kinase 1A1の分解を誘導することを示しましたが、彼らは質量分析を含む基礎的検討にMDS-Lを用いています(Kronke J, et al: Nature 523:183-188, 2015)。
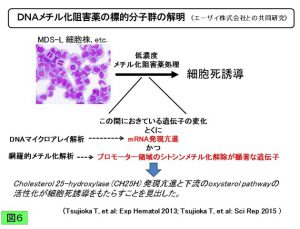
MDS-LはDNAメチル化阻害薬への感受性も高いことから、細胞動態とDNAメチル化との関連についても検討を進めてきました。その結果、DNAメチル化阻害薬処理によって遺伝子発現が亢進し、かつプロモーター領域のシトシンメチル化が低下する遺伝子候補の中からcholesterol 25-hydroxylase (CH25H) に着目しました。さらにその下流のoxysterol pathwayが活性化して細胞死をもたらすことを見出しました(Tsujioka T, et al: Sci Rep 5: e16709, 2015; 図6)。今後臨床検体での検証が望まれます。
本細胞株をin vivoに活用したすばらしい研究として、Cincinnati小児病院のDr. Daniel T. StarczynowskiらによるMDS細胞株in vivoモデルがあります。彼らはヒトSCF、GM-CSF、IL-3を発現するよう遺伝子操作したNSGマウスにMDS-L細胞を移植して、MDSモデルマウスを作製することに成功しました(Rhyasen GW, et al: Cancer Cell 24:90-104, 2013; Rhyasen GW, et al: Leukemia 28:1142-1145, 2014)。同様の研究が他のいくつかのラボでも試みられています。
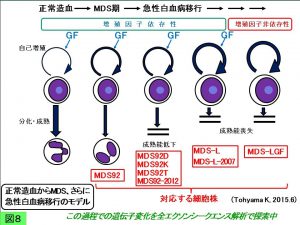
MDS92細胞株は遺伝子不安定性を有していると考えられ、長期間継代培養しているとしばしばMDS-Lに類似した幼若細胞から成る集団が抽出され、一方MDS-Lは元来増殖因子依存性ですが、その中から増殖因子がなくても増殖する亜株が樹立されました。MDS92から派生した亜株のラインアップ を図7に示しました(2015年6月現在)。おそらくMDS期から始まり急性白血病へと段階的に悪性転換していく過程を再現しているものと思われ(図8)、MDS92樹立の発端となった患者骨髄細胞保存検体を出発点として、一連の細胞株が派生していく過程でおこっているエクソームの変化を網羅的に解析してきました。
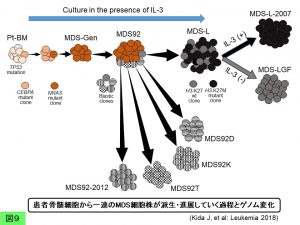
その結果、概略を図9に示したように、患者骨髄の段階ですでにTP53 ホモ変異があったこと、かつその約9%の分画にCEBPA ヘテロ変異があり、その細胞をIL-3存在下にインビトロ培養中にNRAS 変異が加わったことが判明し、これらの変異がMDS92細胞株の樹立につながったと考えられました。さらにここから種々の芽球性亜株が派生しましたが、その中のひとつMDS-Lが出現する過程でヒストンH3(K27M)変異という小児脳幹腫瘍で高頻度に見られる遺伝子変異が付加されたことがわかりました。MDS-LはヒストンH3(K27M)変異のあるクローンと同部位が野生型であるクローンのmixtureでしたが、IL-3存在下ではヒストンH3(K27M)変異クローンが増殖優位性を示した一方、IL-3非存在下では野生型クローンのほうがむしろ優位に維持されることがわかりました。つまりヒストンH3(K27M)変異はdriver mutationですが、それを獲得したクローンはそれだけで腫瘍性増殖にひた走るとは限らず、悪性クローンの拡大は造血因子のような環境要因に影響されることが示唆されました(Kida J, et al: Leukemia 2018)。
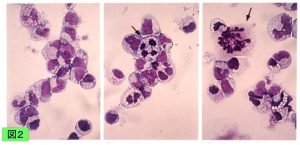
MDS92細胞株
MDS-RAEB患者から樹立。5q-, -7などの核型異常を有する。Leukemia Research誌の総説で、現在availableで唯一のvalid MDS cell lineとして紹介された(Drexler et al: Leuk Res 33:1011-1016, 2009)。
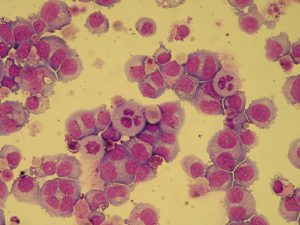
【図3-1】MDS-L細胞株
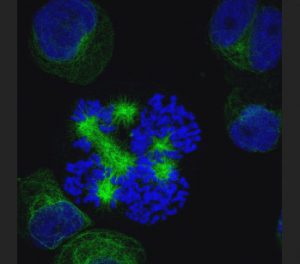
【図3-2】MDS-L細胞株(核と細胞骨格の蛍光染色像)
MDS92から派生した増殖旺盛なblastic cell line。MDS92と同様の核型異常をもつ。
(2) 骨髄異形成症候群の臨床疫学研究
当研究室は厚生労働科学研究・特発性造血障害調査研究班の一員として、MDSの疫学研究・臨床試験や形態学的診断法の策定などの多施設共同研究に参画しており、さらにMDS異形成の中央診断を担当しております。
また本邦における5q-症候群をはじめとする5番染色体異常を有するMDSの実態調査については、多くの施設の先生方のご協力をいただきました(Tasaka T, Tohyama K, et al: Leukemia, 2008; Tasaka T, Tohyama K, et al: Int J Hematol, 2011)。この場を借りまして厚く御礼申し上げます。
(3)血液検査診断学の開発研究
血球形態異常の判定は血液専門医や臨床検査技師の経験則と観察眼に依存していますが、形態異常をもたらす分子基盤はほとんど未解明です。形態異常を呈する細胞の含有DNA量や核構造などの解析を通して、血球分化や形態異常を判定する新たな検査診断学の開拓を目指しています。また造血器腫瘍の遺伝子診断研究(とくにJAK2、calreticulin 遺伝子変異の検出)、赤血球膜異常症の解析研究、血球自動分析システムの向上を目指す産学共同開発研究の推進など臨床検査に直結する研究もおこなっています。とりわけ臨床検査技師の方々に活躍してもらえる領域です。